|
初中化学 > 氧气的制取
氧气的制取
实验原理:2KMnO4
装置注意事项 (1)安装仪器的顺序应是先下后上,合理安装仪器。 (2)药品要平铺在试管底部。 (3)大试管管口必须略向下倾斜,气化后的水变成水蒸气冷凝后倒流入试管底部,使试管炸裂。 (4)铁夹要夹在试管中上部。 (5)在试管口放一小团棉花,防止高锰酸钾粉末进入导气管。 (6)导气管刚刚露出橡胶塞即可,以便于气体的排出。 (7)向上排空气法收集气体时 导气管要伸到集气瓶底部。 实验步骤 (1) 组:将制取装置组装好。 (2)查:检查装置的气密性。 (3)装:将高锰酸钾药品装入试管中,在试管口放一小团棉花。 (4) 定:将装好药品的试管固定在铁架台上,做好相关收集装置的准备。 (5)点:点燃酒精灯开始加热。 (6) 收:等到有连续气泡冒出时开始收集气体。 (7)离:收集完气体将导气管撤离水面。 (8) 熄:停止加热。 注意事项: (1)加热时要先预热,再集中给药品加热 (2)用玻璃片盖加满水的集气瓶瓶口时,可先盖住一小部分,随后推动玻璃片,直至把瓶口全部盖住。如此能保证集气瓶中不存在气泡。 (3)收集气体时要等到有连续均匀的气泡冒出时,开始收集气体。 (4)实验结束后,应先把导管从水槽中取出,然后熄灭酒精灯。反之试管内温度降低,将水倒吸入试管内,会使试管爆裂。
实验室可以用加热高锰酸钾的方法来制取氧气 1 制取氧气的反应原理 2 实验装置及其注意事项3实验操作步骤和注意事项 1. 实验室制取氧气时有下列操作,顺序正确的一组是 [ ] ①向大试管内装药 ②将大试管固定在铁架台上 ③检查装置的气密性 ④点燃酒精灯 A、①②③④ B、②③①④ C、③①②④ D、③②①④ 试题难度:易 2. 小强同学想在实验室制取氧气,实验室有下列仪器以及高锰酸钾、大理石、纯碱、稀盐酸四种药品。(所选仪器不得重复) 请回答下列问题: (1)指出仪器名称①_________________________③_____________________。 (2)在实验室制取该气体的化学反应原理是(请用化学方程式表示)___________________________________,所用仪器____________________________(请用标号表示)。 (3)若改用过氧化氢溶液和二氧化锰混合物制取氧气,其反应的化学方程式为________ __________________________________________________________。 从上图选择仪器画出用此反应原理制取氧气的装置图。 试题难度:中
工业如何制取氧气 工业制氧是指制造大量氧气,大致可分为以下几种方法。 1、空气冷冻分离法 空气中的主要成分是氧气和氮气。利用氧气和氮气的沸点不同,从空气中制备氧气称空气分离法。首先把空气预冷、净化(去除空气中的少量水分、二氧化碳、乙炔、碳氢化合物等气体和灰尘等杂质)、然后进行压缩、冷却,使之成为液态空气。然后,利用氧和氮的沸点的不同,在精馏塔中把液态空气多次蒸发和冷凝,将氧气和氮气分离开来,得到纯氧(可以达到99.6%的纯度)和纯氮(可以达到99.9%的纯度)。如果增加一些附加装置,还可以提取出氩、氖、氦、氪、氙等在空气中含量极少的稀有惰性气体。由空气分离装置产出的氧气,经过压缩机的压缩,最后将压缩氧气装入高压钢瓶贮存,或通过管道直接输送到工厂、车间使用。使用这种方法生产氧气,虽然需要大型的成套设备和严格的安全操作技术,但是产量高,每小时可以产出数千、万立方米的氧气,而且所耗用的原料仅仅是不用买、不用运、不用仓库储存的空气,所以从1903年研制出第一台深冷空分制氧机以来,这种制氧方法一直得到最广泛的应用。 2、分子筛制氧法(吸附法) 利用氮分子大于氧分子的特性,使用特制的分子筛把空气中的氧分离出来。首先,用压缩机迫使干燥的空气通过分子筛进入抽成真空的吸附器中,空气中的氮分子即被分子筛所吸附,氧气进入吸附器内,当吸附器内氧气达到一定量(压力达到一定程度)时,即可打开出氧阀门放出氧气。经过一段时间,分子筛吸附的氮逐渐增多,吸附能力减弱,产出的氧气纯度下降,需要用真空泵抽出吸附在分子筛上面的氮,然后重复上述过程。这种制取氧气的方法亦称吸附法。最近,利用吸附法制氧的小型制氧机已经开发出来,便于家庭使用。 3、电解制氧法 把水放入电解槽中,加入氢氧化钠或氢氧化钾以提高水的电解度,然后通入直流电,水就分解为氧气和氢气。每制取一立方米氧,同时获得两立方米氢。用电解法制取一立方米氧要耗电12—15千瓦小时,与上述两种方法的耗电量(0.55—0.60千瓦小时)相比,是很不经济的。所以,电解法不适用于大量制氧。另外同时产生的氢气如果没有妥善的方法收集,在空气中聚集起来,如与氧气混合,容易发生极其剧烈的爆炸。所以,电解法也不适用家庭制氧的方法。 (二)化学制氧 工业和医用氧气均购自制氧厂。工厂制氧的原料是空气,故价格非常便宜。但是,氧气的贮存(高压氧气用钢瓶、液氧要用特殊贮罐)、运输、使用不太方便。因此远离氧气厂的偏远山区运输困难,另外有些特殊环境如病人家中、高空飞行、水下航行的潜艇、潜水作业、矿井抢救等携带巨大笨重的钢瓶极为不便,小型钢瓶贮氧量小,使用时间短,因此就出现化学制氧法,在化合物中以无机过氧化物含氧量最多且易释放,目前化学制氧多采用过氧化物来制氧。 对无机过氧化合物的科学研究开始于18世纪。1798年德国自然科学家洪堡(Alexandervon Humboldt)采用在高温中把氧化钡氧化的方法,制取了过氧化钡。1810年法国化学家盖一吕萨克(Joseph—Louis Gay—Lussac)和泰纳尔(Louis—Jacques Thenard)合作制取了过氧化钠和过氧化钾。1818年泰纳尔又用酸处理过氧化钡,再经蒸馏发现了过氧化氢。200年来,化学家们不断地研究,发现大量无机过氧化合物。这些过氧化物,在遇热或遇水或遇其他化学试剂的时候,很容易析出氧气。常用的过氧化物有以下几种: 1、液体过氧化物(液体产氧剂)—双氧水 双氧水的化学名称是过氧化氢( 双氧水是过氧化物中最基本的物质,也是各国科学家最早认识的化学产氧剂。双氧水具有产氧量较大(30%的稀释液中,有效氧含量为14.1%)和成本较低的好处。但是,双氧水是强腐蚀剂,稍稍不慎便会造成人身伤害,而且在许多情况下还可引起爆炸或燃烧,无论在使用或贮存、运输中都属于危险品。比如:在常压下,双氧水的蒸气浓度达到40%以上时,温度过高即有爆炸危险。双氧水与有机物混合,能生成敏感和强烈的高效炸药。双氧水与醇类、甘油等有机物混合,就形成极危险的爆炸性混合物。双氧水是强烈氧化剂,对有机物、特别对纺织物和纸张有腐蚀性,与大多数可燃物接触都能自行燃烧。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |



















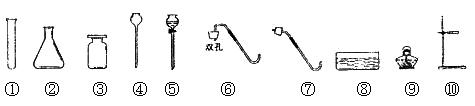


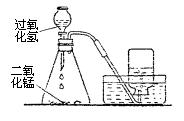
实验室制取气体的方法选择上,应该考虑哪些因素?