|
初中化学 > 白磷的自燃
白磷的自燃
实验步骤 1. 取试剂瓶一只,加少量二硫化碳。将少许白磷加到试剂瓶中,制得含有白磷的二硫化碳溶液。 2. 用镊子夹住一张滤纸,用滴管吸取含白磷的二硫化碳溶液,滴加在滤纸上,直至滤纸全部被溶液润湿。 3. 不久,滤纸边缘由白变黑,最后突然起火燃烧,同时生成大量白烟。
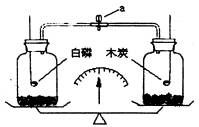
说明 1. 白磷的着火点很低(只有40度),滤纸上的二硫化碳很快挥发后,白磷成为小颗粒附在滤纸上,增大了跟空气的接触面积,白磷暴露在空气中发生缓慢的氧化反应,产生的热量积累,使温度上升到白磷的着火点,就发生了自燃。 2. 白磷有剧毒,该实验应在教师的指导下进行。 3. 剩余的白磷二硫化碳溶液,要妥善处理,以免发生火灾。 白磷着火点比较低,在空气中能缓慢氧化并发生自燃产生大量的白烟,生成白色五氧化二磷固体物质。 1. 白磷熔点低 2. 白磷的储存方法 3. 白磷燃烧的化学方程式 4. 白磷燃烧现象 1. 下列物质在氧气中燃烧时,产生大量白烟的是: A. 碳 B. 磷 C. 硫 D. 铁 试题难度:易 2. 将等容积、等质量(含瓶塞、导管、燃烧匙及瓶内少量的细沙)的两个集气瓶置于天平的左右两盘,调至平衡。放入等质量的白磷和木炭(如图所示),塞紧瓶塞,然后分别设法将其点燃,使二者充分燃烧后冷却至室温,打开弹簧夹(a),此时的天平 A. 指针偏向右 B. 指针偏向左 C. 仍处于平衡状态 D. 指针先向左后向右偏 试题难度:难 1 分析:本题是考查常见物质燃烧的实验现象的一道基础考题。碳在氧气中燃烧发出白光,硫在氧气中燃烧发出明亮的蓝紫色火焰,铁丝在氧气中燃烧火星四射。 答案:B 2 分析:因为两个集气瓶密闭,所以燃烧后天平仍然平衡,打开弹簧夹后,右侧的气体压强大(左侧白磷燃烧消耗氧气生成固体使压强减小,右侧木炭消耗氧气并生成同体积的二氧化碳气体,压强几乎不变),所以气体向左侧流动使左侧托盘下沉,指针向左偏。 答案:B 认识白磷 白磷是一种易自燃的物质,其燃点为40℃,但因摩擦或缓慢氧化而产生的热量有可能使局部温度达到40℃而燃烧。因此,不能说气温在40℃以下白磷不会自燃。 白磷是一种剧毒的物质。人的中毒剂量为15mg,致死量为50 mg。误服白磷后很快产生严重的胃肠道刺激腐蚀症状。大量摄入可因全身出血、呕血、便血和循环系统衰竭而死。若病人暂时得以存活,亦可由于肝、肾、心血管的功能不全而慢慢死去。皮肤被磷灼伤面积达7%以上时,可引起严重的急性溶血性贫血,以至死于急性肾功能衰竭。常期吸入磷蒸气,可导致气管炎、肺炎及严重的骨骼损害。 由于白磷非常危险,因此不能将白磷露置于空气中。根据白磷不溶于水,且比水的密度大,可以将少量的白磷放入盛有冷水的广口试剂瓶中,并经常注意保持足够的水量。通过水的覆盖,既可以隔绝空气,又能防止白磷蒸气的逸出,同时还能保持白磷处于燃点之下。不常用的白磷可以贮存于封口的试剂瓶中,并埋入沙地里。 白磷虽然危险,但也有很多用途。在工业上用白磷制备高纯度的磷酸。利用白磷易燃产生烟(P2O5)和雾(P2O5与水蒸气形成H3PO4),在军事上常用来制烟幕弹。还可用白磷制造红磷、三硫化四磷、有机磷酸酯、燃烧弹、杀鼠剂等。 白磷又叫黄磷,为白色至黄色蜡性固体,熔点44.1°C,沸点280°C,密度1.82g/cm3 如果氧气不足,在潮湿情况下,白磷氧化很慢,并伴随有磷光现象。白磷可溶于热的浓碱溶液,生成磷化氢和次磷酸二氢盐;干燥的氯气与过量的磷反应生成三氯化磷,过量的氯气与磷反应生成五氯化磷。磷在充足的空气中燃烧可生成五氧化二磷,如果空气不足则生成三氧化二磷。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |




















白磷为什么储存在冷水中?