|
初中化学 > 二氧化碳和石灰水作用
二氧化碳和石灰水作用
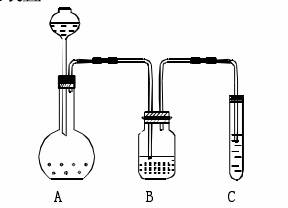
实验步骤 1. 试管中加入1/3体积的澄清石灰水。 2. 试管内插入玻璃导管,用嘴向澄清石灰水中吹二氧化碳,不久,澄清石灰水变浑浊,有白色的不溶性物质碳酸钙生成。 3. 继续向试管中吹二氧化碳,过一会儿,浑浊的溶液又变澄清,生成了碳酸氢钙。 4. 用试管夹夹住试管后,点燃酒精灯,加热试管中的澄清溶液,不久,溶液复变浑浊。说明碳酸氢钙不稳定,受热分解成碳酸钙。 实验原理: CO2 + Ca(OH)2 == CaCO3 ↓ + H2O 二氧化碳跟足量石灰水反应生成碳酸钙沉淀和水。该实验可用于鉴别二氧化碳。 1. 反应化学方程式的书写 2. 实验现象 3. 石灰水的保存及变质 1. 能把氧气与二氧化碳、一氧化碳与二氧化碳、氮气与一氧化碳、甲烷和二氧化碳都区别出来的是( ) A. 分别通入澄清的石灰水 B. 分别通人紫色石蕊试液 C. 用燃着的木条检验 D. 以上几种方法都行 试题难度:易 2. 长期敞口放置的石灰水的内壁会有一层坚硬的薄膜,很难用水洗掉,但可用稀盐酸浸泡后洗掉,原因是(写方程式):硬膜形成①_____________________去掉硬膜②____________________ 试题难度:中 3. 在建筑工业上常用石灰石煅烧得到生石灰(CaO),溶于水后得到熟石灰[Ca(OH)2],再粉刷到墙上,一段时间后,发现墙会“出汗”,请写出其间发生的反应方程式①_____________________②_____________________③__________________。 试题难度:中 二氧化碳与石灰水反应研究 1、问题的提出 多年来一直有这样的说法:将CO2通入澄清石灰水中,澄清石灰水逐渐变浑浊; 继续通入CO2,浑浊液又转变为澄清。 事实是否如此呢?我们进行了相关实验。 (1)实验装置 装置A: CO2发生装置,平底烧瓶中装石灰石,滴液漏斗中盛盐酸(1:1),装置B为洗气瓶,盛饱和碳酸氢钠溶液,C中盛饱和澄清石灰水。 (2)实验说明 气体发生装置中生成的一氧化碳气体会带出一定量HCl气体而影响C中反应,所以使用饱和碳酸氢钠溶液洗除HCl气体,保证进入C的气体为纯CO2气体。 (3)实验结果 随着CO2的通入,饱和澄清石灰水逐渐变浑浊,继续通入过量CO2,浑浊程度逐渐减小,但最终浑浊液无法完全变成澄清的溶液。 通过实验我们可以发现,事实上一直以来我们的说法是存在问题的,为什么此时的石灰水并没有像我们所说的那样最终变为澄清呢? 2、分析与结论 (1)实验原理 这里涉及的两个反应都是中学教学的经典反应: CO2 + Ca(OH)2 == CaCO3 ↓ + H2O CaCO3为溶解度较小的物质,Ca(HCO3)2为溶解度较大的物质,也正是在这个理论基础上,人们才一直认为澄清石灰水会先变浑浊再逐渐澄清。 而上述实验却证明最终无法使饱和澄清石灰水恢复澄清,是什么原因呢?笔者进行如下系列分析: 附表:实验中涉及的物质及相关数据 (2)数据分析 问题的关键是CaCO3能否完全反应生成Ca(HCO3)2,这个反应涉及碳酸钙的溶解平衡、碳酸的两步电离平衡、碳酸氢根的水解平衡,而使这几个平衡相联系的关键是碳酸根离子。 分析方法一:由于最终反应结束时溶液中既存在碳酸氢钙又有碳酸钙,直接计算有困难,因此我们使用比较法,先假设溶液能够变澄清,计算此时溶液需要满足的条件,再与实际情况进行比较,从而找到溶液无法澄清的原因。比较点可以选择CO32-浓度,也可以选择溶液中H+浓度。因为CO32浓度与H+浓度密切相关,又因计算CO32所涉及的化学平衡较多较复杂,笔者选择H+浓度为比较点。 根据表格中的数据我们进行以下计算: (1)饱和澄清石灰水中Ca2+的浓度, 由于饱和石灰水电离出的OH一浓度远远大于水本身的电离,且对水的电离有抑制,因此我们可以近似的认为: 原饱和澄清石灰水中的钙离子数等于反应结束时溶液中的总钙离子数,即0.011m ol/L。 (2)可完全溶解值与实验情况的比较 ①在Ca2+浓度一定的情况下,CaCO3。可完全溶解时,溶液中CO32-最大允许浓度: [CO32]=Ksp/[ Ca2+]=2.8×10-9÷1.1×10-2=2.5×10-7(mol/L) 设溶液为澄清,所以[HCO3-]=2[Ca2+]=2×0.011=0.022(mol/L) 此时溶液酸性[H+]=Ka2·[HCO3-]/[ CO32-]=5.6×10-11×0.022÷2.5×10-7=4.9×10-6(mol/L) 即若要使饱和石灰水溶液最后变澄清,溶液pH应小于5.3 。 ②实际反应中的情况 碳酸所能提供的酸性是有限的,实验证明溶液偏碱性。不可能达到CaCO3完全溶解的溶液pH要求。 通过比较我们从理论上解释了溶液无法变澄清的原因。 分析方法二:从CO32-浓度出发,使用反证法,假设在碳酸作用下最终饱和澄清石灰水可以完全反应生成碳酸氢钙: 可用最简式计算 [H+]=(Ka1·Ka2)1/2=(4.3×10-7×5.6×10-11)1/2=4.8×10-9(mol/L) 而[CO32-]= Ka2·[HCO3-]/[H+]=5.6×10-11×0.022÷4.8×10-9=2.6×10-4(mol/L) 2+ 此时溶液中的[CO32-]和[Ca2+]的乘积:[CO32-]·[Ca2+]=2.86×10-6 通过计算可以发现[[CO 3、结论 二氧化碳与澄清石灰水反应现象是与澄清石灰水浓度有关的,在学习中不能片面强调二氧化碳与澄清石灰水反应时最终能出现澄清现象。 需说明的问题: 在实际教学中有些时候会出现溶液最终能恢复澄清,其原因可能有以下几个: ①澄清石灰水在存放的时候,已经部分与空气中的CO2发生了反应,使溶液中Ca(OH)2的浓度降低。 ②未使用洗气瓶,制备一氧化碳时有一部分盐酸随一氧化碳气体进入溶液与Ca(OH)2,CaCO3反应。 ③澄清石灰水在使用前稀释了。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |





















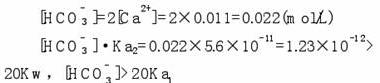
二氧化碳跟氢氧化钙反应的实质是什么?