|
初中化学 > 一氧化碳还原氧化铜
一氧化碳还原氧化铜
实验步骤 1. 按从下到上、从左到右的顺序,将实验仪器装配好。 2. 将小纸槽中少量的氧化铜粉末平铺在粗玻璃管中部。 锥形瓶中加入一些澄清的石灰水。 3. 先通入纯的一氧化碳气体,稍过片刻,排尽管内空气后,点燃从尖嘴管中排出的一氧化碳。 4. 点燃酒精灯,预热玻璃管,然后,集中在盛有氧化铜粉末处加热。 5. 不久,锥形瓶内澄清的石灰水变浑浊,试管内的黑色粉末变成了红色的铜。 6. 熄灭酒精灯,继续通入一氧化碳,尖嘴导管口燃着的火焰离开硬质试管,直至试管冷却。
说明 一氧化碳有毒,没有反应完的一氧化碳,应在尖嘴导管口点燃转变成二氧化碳,不能将一氧化碳直接排放到室内。 实验原理: 实验考点: 1. 化学反应方程式 2. 实验现象 3. 尾气处理 一氧化碳跟氧化铜反应生成铜跟二氧化碳。
1. 化学反应方程式 2. 实验现象 3. 尾气处理 1. 氢气、木炭、一氧化碳分别跟灼热的氧化铜反应,下列叙述正确的是( ) A. 反应后都有二氧化碳生成 B. 反应的实验装置相同 C. 反应后都有红色固体生成 D. 反应类型均属于置换反应 试题难度:易 2. 钢铁的冶炼是人类文明的一个重要标志,下图是模拟炼铁的实验装置图。 (1)请你写出冶炼生铁的化学方程式 (2)请写出一种证明产物中含铁粉的方法: (3)此装置有不完善的地方,请写出其中一种改进的方法 。 (4)根据实验可知一氧化碳和二氧化碳的化学性质是不同的,请根据你的认识写出一点: 。 试题难度:中 走近一氧化碳 1. 用途 燃料,还原剂,有机合成的原料,用于制备羰基金属、光气、硫氧化碳、芳香族醛、甲酸、苯六酚、氯化铝、甲醇,用于氢化甲酰化作用,用于制备合烃(合成汽油)、合醇(羧酸、乙醇、醛、酮及碳氢化合物的混合物),锌白颜料,氧化铝成膜,标准气,校正气,在线仪表标准气。 2. 制法 (1)碳氢化合物气体(天然气、丙烷、炼油厂气)经过活性碳层脱硫后与水蒸气及CO2混合,然后通过装满镍催化剂的反应管(温度 CH4+H2O→CO+3H2 CH4+2H2O→CO2+4H2 因为在原料气中有CO2,优先进行前一个反应。经过脱水及吸收除掉CO2之后从分离塔的塔底和塔顶分别得到CO和H2。CO纯度可达98.6%。 (2)CO2与烧红的煤相互作用。 (3)焦碳或煤的不完全燃烧。 (4)水煤气或煤气中分离出。 (5)蚁酸与浓硫酸作用。 一氧化碳在常温常压下为无色、无臭、无味、无刺激性的窒息性气体。空气中可燃,燃烧时发出蓝色火焰。与空气混合形成爆炸性混合物。与酸、碱和水不起反应。在高温高压下,与铁铬镍等金属反应生成羰基金属,与氯结合形成光气,与羰基金属结合形成羰基金属化合物。一氧化碳具有还原作用,在室温下有锰及铜的氧化物混合存在时,一氧化碳可氧化成CO2,有一种防毒面具就是利用这种原理制成的。 一氧化碳是有毒气体,它是在没有任何刺激的情况下进入人体慢慢引起中毒。这时,人不仅感觉不到而且还有某种快感,所以它更是危险可怕的气体。它微溶于水,易溶于盐酸、氨水和氯化亚铜溶液,也溶于乙酸乙酯、三氯甲烷、乙酸等有机溶剂。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |



















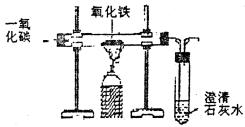

对比分析氢气、木炭和一氧化碳还原氧化铜的优缺点。