|
初中化学 > 盐酸与金属反应
盐酸与金属反应
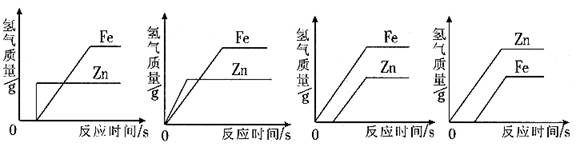
实验步骤 1. 用镊子夹取几粒锌粒,把锌粒放在试管口,然后慢慢地将试管直立,锌粒滑到试管底部。 2. 用同样的方法,将铜片放到另一支试管中。 3. 向两支试管中分别滴加2毫升盐酸,锌粒与盐酸接触,锌粒表面有氢气泡产生。铜片与盐酸接触无任何现象。 反应原理 Zn + 2HCl = ZnCl2 + H2 ↑ Cu + HCl---->不反应 金属活动顺序表中氢元素前面的金属能跟盐酸反应成氢气,而氢后面的金属则不能。 1. 金属活动顺序表 2. 金属活动顺序表的应用 1. 下列按失电子能力由易到难顺序排列正确的是( )。 A. K、Fe、Zn、Hg B. K、Zn、H、Hg C. Na、Mg、Ag、Hg D. Zn、Ag、Cu、Hg 试题难度:易 2. 等质量的锌、铁与足量的稀硫酸反应,下列产生氢气的质量与反应时间的关系图,合理的是() A B C D
试题难度:中 3. 梦颖同学用实验探究Fe、Mg、Cu等三种金属活动性顺序时,有关反应记录如下: (1)从上述反应中,可获取的信息有:____________ (2)梦颖说,能从实验过程中发现镁比铁活泼,其依据是_________。如果补充一个实验(用化学方程式表示)________,也能说明镁比铁活泼。 (3)我们能用金属活动性顺序解释生活中的一些现象,如_______________。 试题难度:中 1 分析:在金属活动性顺序中,金属位置越靠前,它在水溶液中就越易失电子。故只要熟记金属活动性顺序表就过了第一关。 答案:B 2 分析:金属活动性越强,越容易发生置换反应,与酸反应生成氢气的速率越大,同价态的不同金属与足量酸反应,金属相对原子质量越小,放出氢气的质量就越多。反之,则越少。由于在金属活动顺序中锌比铁活泼,且铁的相对原子质量小于锌,故等质量的锌和铁与酸反应,铁产生的氢气比锌多。在相同时间内,锌与酸反应的速率大于铁与酸反应的速率。 答案:B 3 分析及答案: (1)由题给反应记录可获取的信息有:Mg、Fe均可与盐酸反应放出H2;Fe的金属活动性比Cu强;Cu不能与盐酸反应。 (3)用Fe与CuSO4反应来冶铜。 金属性和金属活动性 金属元素的原子在化学反应中,通常表现出失去电子成为阳离子的倾向。金属性的强弱通常用金属元素原子的最外层电子的电离能(气态原子失去电子成为气态阳离子时所需要的能量)大小来衡量。 金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,它是以金属的标准电极电势为依据的。从能量角度来看,金属的标准电极电势除了与金属元素原子的电离能有关外,同时还与金属的升华能(固态单质变为气态原子时所需的能量)、水合能(金属阳离子与水化合时所放出的能量)等多种因素有关。 金属性强的元素,一般来说它的活动性也大,但也有不一致的情况。例如,钠的第一电离能比钙的第一电离能要小,因此钠的金属性要比钙强。但是钙在水溶液中形成水合离子的倾向比钠大,即钙的标准电极电势比钠要负,所以钙的金属活动性比钠大。铜和银也有类似上述的情况。由此可见,金属性与金属活动性两者概念是有区别的。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |




















把金属镁、铁、锌分别放入相同的盐酸中,观察现象?解释原因。