|
初中化学 > 气体的性质实验
气体的性质实验
实验问题 几种常见气体和空气的性质见下表
实验分析: 本题有两个要求: (1)明确选用气体收集装置的基本原理:难溶于水的气体可用排水法;相同条件下比同体积空气重的气体可用向上排空气法;相同条件下比同体积空气轻的气体可用向下排空气法; (2)阅读表格中的数据,比较出一些气体比空气重还是轻?从溶解性数据中判断出气体溶解的难易程度。从而确定气体的收集装置。
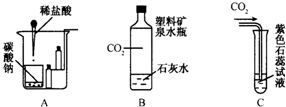
气体的收集方法由它的物理性质决定。 1 常见气体的性质实验 2 应用基本性质的综合实验 1 将N2、CO2、H2、CO等气体组成的混合气体依次通过足量的石灰水、灼热的氧化铜和干燥剂后,剩余的气体是( ) A. N2 B. N2和CO 试题难度:易 2. 区别H2、O2、CO2三种气体最简便的方法是( ) A、将气体分别通入石灰水 B、用燃烧着的木条分别伸入盛有三种气体的集气瓶里 C、将气体分别通过灼热的氧化铜 D、将气体分别通过红热的铜丝 试题难度:易 3. 某研究性学习小组的同学在学习二氧化碳有关知识后,又查阅相关资料,对二氧化碳知识进行梳理。 (1)下图所示的是有关二氧化碳性质的实验。
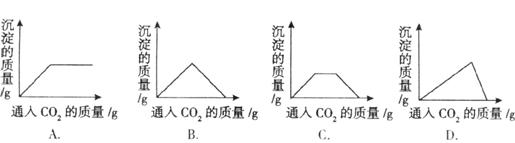
(2)由于人类消耗的能源急剧增加,森林遭到破坏,大气中CO2的含量上升,造成温室效应,有人建议多植树造林以减少CO2的含量,其原理是: 6CO2+6H2O=====C6H12O6+6O2,则C6H12O6中碳元素的质量分数是 。 化学家也致力于CO2的“组合转化”技术研究,把过多的CO2转化为有益于人类的物质。如将CO2与H2混合,在一定条件下按分子个数比为1∶4的比例发生反应,生成某种重要的化工原料和水。该化工原料是 。写出该化工原料的用途(用化学方程式表示) 。 (3)将二氧化碳通入澄清石灰水中,有白色沉淀生成,若继续通入二氧化碳,白色沉淀将完全溶解。其反应的化学方程式为:①Ca(OH)2+CO2=CaCO3↓+H2O②CaCO3+CO2+H2O=Ca(HCO3)2,当二氧化碳持续不断地通入澄清石灰水中时,沉淀质量的变化符合下列图中的是 。 试题难度:难
1 分析:石灰水吸收了CO2,氧化铜吸收了H2、CO但产生CO2和水,干燥后剩余N2和CO2 答案:B 2 分析:用燃烧着的木条分别伸入盛有三种气体的集气瓶里,木条熄灭的原气体是CO2,木条燃烧更旺的原气体是O2,气体被引燃的原气体是H2 答案:B 3 分析:本题(1)综合考查了二氧化碳的物理性质和化学性质的实验,通过对实验仪器和方法的改变,都有明显的实验现象来说明二氧化碳的相关性质。并把气体实验跟压强结合起来,体现了学科间的综合。(2)考查了气体性质应用和相关化学式计算内容。(3)考查用图像描述实验的知识,图像要注意曲线的起点、拐点和终点,三者对应好了,才能准确作出相应的图像。 答案:
(1)
(2)40% CH4 CH4+2O2
学习在于积累。特别对于化学的学习更是如此。学习化学的都知道,化学学科的特点是知识琐碎,如果平时不注意积累,到头来不免象猴子摘棒子,什么也落不着。 气体是中学化学中常见到的重要物质,如果对气体的有关知识做一下总结,相信对同学们的学习会有一定的帮助。也希望借此抛砖引玉,启发大家对所学知识进行归纳,使自己的学习上一个新台阶。 下面仅就中学所见到的一些气体的知识做一归纳。 1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。 2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。 3、极易溶于水能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。 4、易液化的气体:NH3、Cl2、SO2 。 5、有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO2、NO、Br2(g)、HCN。 6、在空气中易形成白雾的气体:NH3、HF、HCl、HBr、HI。 7、常温下不能共存的气体:H2S和SO2、H2S和Cl2、HI和Cl2、NH3和HCl、NO和O2、F2和H2。 8、其水溶液呈酸性的气体:HF、HCl、HBr、HI、H2S、SO2、CO2、NO2、Br2(g)。可使湿润的红色石蕊试纸变兰的气体:NH3。 9、有漂白作用的气体:Cl2(有水时)和SO2,但两者同时使用时漂白效果减弱。常用Cl2能使湿润的紫色石蕊试纸先变红后褪色来检验Cl2的存在。 10、能使澄清石灰水变浑浊的气体:CO2和SO2,但通入过量气体时沉淀又消失。 11、在空气中可以燃烧的气体:H2、CO、CH4、C2H4、C2H2、H2S。在空气中燃烧火焰呈蓝色(或淡蓝色)的气体:H2S、H2、CO、CH4。 12、具有强氧化性的气体:F2、Cl2、Br2(g)、NO2、O2、O3;具有强或较强还原性的气体:H2S、H2、CO、NH3、HI、HBr、HCl、NO;SO2和N2既具有氧化性又具有还原性。 13、与水可反应的气体:Cl2、F2、NO2、Br2(g)、CO2、SO2、NH3;其中Cl2、NO2、Br2(g)与水的反应属于氧化还原反应(而且都是歧化反应),只有F2与水剧烈反应产生O2。 14、能使湿润的淀粉碘化钾试纸变蓝的气体:Cl2、NO2、Br2(g)。 15、能使溴水和酸性高锰酸钾溶液褪色的气体:H2S、SO2、C2H4、C2H2。 16、可导致酸雨的主要气体:SO2;导致光化学烟雾的主要气体:NO2等氮氧化物和烃类;导致臭氧空洞的主要气体:氟氯烃(俗称氟利昂)和NO等氮氧化物;导致温室效应的主要气体:CO2和CH4等烃;能与血红蛋白结合导致人体缺氧的气体是:CO和NO。 17、可用作致冷剂或冷冻剂的气体:CO2、NH3、N2。 18、用作大棚植物气肥的气体:CO2。 19、被称做地球保护伞的气体:O3。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |




















查阅资料,气体收集还要注意哪些问题。