|
高中化学 > 氢氧化亚铁的制备
氢氧化亚铁的制备
实验内容
操作方法
现象
溶液中加入溶液,二者发生反应,生成白色絮状沉淀,反应方程式为: FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 在空气中被氧气氧化成红褐色。方程式为: 4Fe(OH)2+O2+2H2O=4Fe(OH)3 1、强碱制备弱碱规律的应用;2、氢氧化亚铁的制备及其还原性
1、下列实验中,仪器的下端必须插入液面以下的是 ( ) ①制备氢气的简易装置中加入稀硫酸的长颈漏斗 ②制备氯气装置中的分液漏斗 ③用新制的硫酸亚铁溶液和氢氧化钠溶液制备氢氧化亚铁操作中的胶头滴管 ④用乙醇制取乙烯时的温度计 ⑤蒸馏石油时的温度计 A、①③ B、②④⑤ C、①③④ D、全部 试题难度:易 2、有一黑色固体A,在氧气中焙烧,得红棕色固体B和气体C.将A加入HCl中,得到D气体和E溶液.在E溶液中加足量NaOH溶液,得到白色沉淀,将该白色沉淀取出置于空气中,然后在空气中加热,可得到B,回答下列问题: (1)写出A、C、D的化学式:A __________ ,C __________ ,D ____________. (2)白色沉淀在空气中变化的现象是:_________________________,其化学方程式为 ______________________ . 试题难度:中 3、用下面两种方法可以制得白色的Fe(OH)2沉淀。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入___________ 。 (2)除去蒸馏水中溶解的O2常采用___________ 的方法。 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作 的理由是 ___________ 。 方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是___________。 (2)在试管Ⅱ里加入的试剂是 ___________ 。 (3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是___________ 。 (4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________。 试题难度:难 1 答案:C 解析:属于基本实验基本操作问题,属于记忆性内容。注意制备氢氧化亚铁时胶头滴管的特殊使用。
4Fe(OH)2+O2+2H2O ==4Fe(OH)3 解析:本题切入点:红棕色固体B为氧化铁。白色沉淀在空气中加热,可得到B,说明沉淀为氢氧化亚铁。说明A中含有+2价Fe。A在氧气中焙烧【被氧化】、加入HCl中,得到两种不同的气体,说明与HCl溶液反应得到的气体被氧化后还是气体,结合固体A为黑色,确定为FeS。
解析:方法一的几个问题主要考查Fe2+的水解性和还原性,实验设计和操作围绕这两个方面思考就可以得到正确答案了。方法二在解答问题之前必须搞清实验设计意图,它是根据压强原理巧妙避免氧气对Fe(OH)2沉淀的影响,围绕这一原理展开得正确答案。 亚铁离子在空气中都不稳定? 我们在中学化学的学习中,经常遇到有关+2价Fe的习题,不管是Fe2+的固体还是溶液,都易被空气中的氧气氧化,亚铁离子在空气中都不稳定吗?下面介绍一种物质---亚铁氰化钾。 化学式K4[Fe(CN)6] ·3H2O ,学名三水合六氰合铁(Ⅱ)酸钾。浅黄色晶体。为铁和氰形成的配位化合物。俗称黄血盐。易溶于水,在水溶液中离解为K+和[Fe(CN)6]4-。亚铁氰化钾在空气中稳定,加热至70℃失去结晶水,强热后分解。铁(Ⅲ)盐溶液与亚铁氰化钾反应,得到蓝色的普鲁士蓝沉淀,化学式为K[FeⅡ(CN)6FeⅢ],此反应用于检验Fe3+。亚铁氰化钾用于制造蓝色颜料、染料、晒图纸,用作钢铁生产的淬火剂。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |











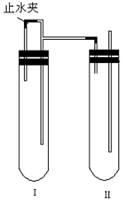

制备氢氧化亚铁的方法很多,除了以上设计到的方法(含试题中)之外,你还能想出哪些方法?如果利用电化学原理,你能设计出实验装置图吗?