|
高中化学 > 有关过氧化钠的性质实验
有关过氧化钠的性质实验
操作方法 1、在一干燥的试管里放入一小匙过氧化钠,观察过氧化钠的颜色。向试管里加入约3mL水,并用带火星的木条检验产生的气体。 2、用盐酸与碳酸钙反应生成二氧化碳,与过氧化钠反应有氧气生成使带火星的蜡烛复燃.
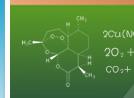
实验现象 过氧化钠是淡黄色的固体,能与水反应,放出气体使带火星的木条复燃。二氧化碳与过氧化钠反应使蜡烛复燃 实验结论 过氧化钠与水反应产生氧气使木条复燃。 方程式为 2Na2O2+2H2O=4NaOH+O2↑ 二氧化碳与过氧化钠反应使蜡烛复燃了。 方程式为 2CO2+2Na2O2=2Na2CO3+O2 所以过氧化钠用在呼吸面具上和潜水艇里作为氧气的来源。 过氧化钠与水、二氧化碳反应都生成氧气,使带火星的木条复燃。 1、过氧化钠与水、二氧化碳反应的现象以及应用;2、过氧化钠的氧化性考查;3、差量法计算
1、与水作用生成碱并有气体放出的是( ) A、Na2O B、SiO 试题难度:易 2、在下列反应中,Na2O2只表现出强氧化性的是( ) A、2Na2O2+CO2=2Na2CO3+O2 B、Na2O2+MnO2=Na2MnO4 C、2Na2O2+H2SO4=2Na2SO4+2H2O+O2↑ D、5Na2O2+2MnO4-+16H+=10Na++2Mn2++5O2↑+8H2O 试题难度:中 3、A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质。 (1)写出A→E的化学式: A B C D E (2)写出A→D、C→D、C→E反应的化学方程式 A→D C→D C→E 试题难度:难 1 答案:CD 2 答案:B 解析:利用化合价的变化来判断。 3 答案:(1)Na、Na2O、Na2O2、NaOH、Na2CO3, (2)2Na+H2O = 2NaOH+H2↑, 2Na2O2+2H2O = 4NaOH+O2↑, 2Na2O2+2CO2 = 2Na2CO3+O2 解析:根据A与空气或氧气的反应条件不同,反应不同,推知A为金属钠。 过氧化钠 ①结构:[-O-O-]2-过氧离子,在[-O-O-]2-中,氧与氧之间是共价键。氧元素为-1价。从化学结构式看,过氧化钠分子比氧化钠稳定。 ②物理性质:淡黄色固体(粉末),商品常制成圆形小颗粒。熔点约为 ③化学性质:过氧化钠不是碱性氧化物,但也可与水、二氧化碳、酸反应,反应过程中均有氧气放出,反应放热。化学方程式分别为: 2Na2O2 + 2H2O ══ 4NaOH + O2↑ 2Na2O2 + 2CO2 ══ 2Na2CO3 + O2 根据这个性质,可将它用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用。 2Na2O2 + 4HCl ══ 4NaCl + 2H2O + O2↑ 2Na2O2 + 2H2SO4(稀)══ 2Na2SO4 + O2↑+ 2H2O 与次高价非金属氧化物发生氧化还原反应,生成盐,但不放出氧气,如: Na2O2 + CO ══ Na2CO3 Na2O2 + SO2 ══ Na2SO4 另外,O2投入FeCl2溶液中可将Fe2+氧化成Fe3+,生成Fe(OH)3沉淀。 Na2O2投入H2S溶液中可将H2S氧化成单质硫。 过氧化钠与强氧化剂,如高锰酸钾,作用也显示还原性。 ④过氧化钠的用途:过氧化钠在工业上常用做供氧剂,漂白剂、杀菌剂、消毒剂、去臭剂、氧化剂等。 ⑤通常可通过在不含二氧化碳的干燥空气流中把金属钠加热到  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |


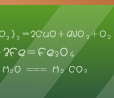











将过氧化钠和单质碘混合在一起,用塑料管对混合物轻轻吹气,能看到什么现象?