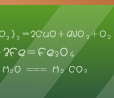|
高中化学 > 氨气的制取
氨气的制取
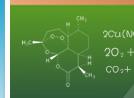
实验目的 学习实验室制取氨气的方法。 实验用品 铁架台,铁夹,酒精灯,两个大试管,棉花;氯化铵固体,氢氧化钙固体。 实验原理 2NH4Cl + Ca(OH)2 注意事项 ①.a. 一般用Ca(OH)2,而不用NaOH,因NaOH碱性太强,对大试管的腐蚀比Ca(OH)2强。 b. 选用Ca(OH)2时要检验消石灰是否变质,因经过长期存放后消石灰部分变成碳酸钙,最好用新制的消石灰。 c. NH4Cl与Ca(OH)2质量比以5:8为宜,如用 (NH4)2SO4代替NH4Cl,则质量比为1:1,消石灰过量,以防止生成氨合物。 ②a. 试管口(盛固体药品的试管)要略向下倾斜; b. 固体药品要平铺试管底部; c. 导出氨气的导管要短,收集氨气的导管要长,伸入试管底部; d. 为使氨气收集更多,防止空气中的水蒸汽进入收集氨气的试管,在试管口放一块棉花,但不能堵死。 e. 酒精灯加热用外焰,先均匀加热,后对准固体加热。 收集方法 用向下排气法收集。因氨气极易溶于水,比空气轻。 实验室制取氨气也可采用常温下用浓氨水与固体烧碱混合的方法来制氨,只要将浓氨水滴入盛有固体烧碱的烧瓶中,待冒气泡较多时,即可用向下排气法收集氨气。 干燥氨气 用碱石灰,不能用浓硫酸和氯化钙干燥氨气。检验氨气用湿润的红色石蕊试纸,氨气能使湿润的红色石蕊试纸变蓝。 实验室可以用氯化铵固体和氢氧化钙固体来制取氨气。
1、氨气的制取原理、除杂、收集;2、实验室制取氨气的装置。
1、在实验室里,可用同一套仪器制取的气体是 A.NH3和Cl2 B.NH3和O 试题难度:易 2、为了更简便地制取干燥的NH3,下列方法中适合的是 ( ) A.NH4Cl与H2SO4(浓)混合加热,生成的气体用碱石灰进行干燥 C.加热浓氨水,气体用碱石灰干燥 D.加热NH4HCO3,气体用P2O5干燥 试题难度:中 3、制取氨气并完成喷泉实验(如图,图中夹持装置均已略去) (1)写出实验室制取氨气的化学方程式: (2)收集氨气应使用 法,要得到干燥的氨气,可选用 作干燥剂。 (3)用甲图装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发上喷的操作是 。该实验的原理是 (4)如果只提供乙的装置,请说明引发喷泉的方法。 试题难度:难 超纯气体的制备方法 又称高纯气体,指纯度高于99.99%的气体,是一种高纯化学试剂。为适应一些科学研究和尖端技术的特殊需要而制备。一些对气体要求特别纯净的部门,需要超纯气体的纯度高达99.9999%以上,每升气体中粒度大于0.5m的尘粒数应少于三个。 品种和用途 超纯气体的品种发展十分迅速,1981年单一超纯气体120多种,混合超纯气体12类约300多种。中国能生产单一超纯气体十多种,混合超纯气体几十种。除主要品种外,单一超纯气体还有二氧化硫、一氧化碳、二氧化碳、乙烯、正丁烷、砷烷、丙二烯、顺丁烯、丁二烯等。混合超纯气体为上述单一超纯气体的混合气,分别有专门的用途,如纯氩-氮混合气用于电光源中钨丝的还原,纯氩-氖混合气、氩-氦混合气用于霓虹灯充气等,还有不少超纯混合气体作为色谱、质谱和光谱分析中的标准气。 制备方法:超纯气体的制备大多是从工业气体加以纯化,有吸附法、吸收法、薄膜扩散法、电解法、生化法、辐射法、光解法、低温精馏法、催化法等。例如超纯氢、氮、氦、氩,先通过空气分离提取较纯气体,再经低温吸附得到超纯气体;粗氩也可以从合成氨弛放气中提取;粗氪、氙从核裂变气中提取,再经纯化而得超纯气体。 贮运 对于超纯气体,任何微小的污染都会严重影响气体的质量,因此气体贮存和运输过程中的洁净和高度密封性特别重要。超纯气体主要采用高压钢瓶或低温液化气体容器贮存和运输。高压钢瓶坚实耐用,运输和使用灵活,气体无损耗,但气体纯度稳定性较差;低温液化气体容器单位容积贮量很大,但有气体排放损耗。 探讨课题
为什么用固体制取氨气需要加热,而用溶液制取在常温下即可?
最新评论共有 位网友发表了评论
查看所有评论
发表评论
 北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |