|
高中化学 > 氨与酸反应
氨与酸反应
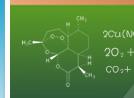
操作方法一 取两根干净的玻璃棒,拿一根玻璃棒在浓氨水里蘸一下,另一根玻璃棒在浓盐酸里蘸一下,使两根玻璃棒接近但不接触,观察现象。 实验现象 二棒接近后可看到大量白烟产生。 操作方法二 将制取氨气的试管按图安装好。在玻璃片的不同地方各滴一滴浓硫酸,浓硝酸,浓盐酸,然后加热氯化铵和氢氧化钙混合物,当有氨气放出时,移动玻璃片,使导管依次对着三滴不同的酸。观察现象。 实验现象 导管对着浓硝酸和浓盐酸冒白烟,而对着时间稍长时,液滴处有白色晶体析出。导气管对着浓硫酸时无冒白烟现象,只有白色晶体析出。 1 白烟是氨水里挥发出来的氨气跟浓盐酸挥发出来的氯化氢化合生成微小的氯化铵晶体。方程式为:NH3 + HCl =NH4Cl 2 浓硝酸和浓盐酸有挥发性,挥发出来的HNO3和HCl遇氨气产生NH4NO3晶体颗粒和NH4Cl晶体颗粒,所以冒白烟,当生成NH4NO3和NH4Cl量较多时,析出白色晶体。浓硫酸无挥发性,遇氨气不冒白烟,但H2SO4与NH3能发生反应生成(NH4)2SO4而析出白色晶体 1、碱性气体氨气的化学性质与酸或HCl等酸性气体在常温下的反应;2、氨气的检验方法。
|