|
高中化学 > 硝酸钾的分解
硝酸钾的分解
操作方法 取一支洁净的试管,装入一药匙硝酸钾加热到融化,把带有火星的细木条伸到试管口检验放出的气体,并观察现象。 实验现象 硝酸钾受热融化,将带有火星的细木条伸到试管口,产生的无色气体能使木条复燃 硝酸钾受热分解有氧气放出。 反应方程式:2KNO3 1、硝酸盐分解规律与分解方式;2、分解产物的性质与计算。
1、取0.5mol 硝酸铵在一定条件下加热可分解生成0.2mol硝酸和 A. N2O B. N 试题难度:中
2、硝酸钾受热分解的化学方程式为2KNO3=2KNO2+O2↑,硝酸银受热分解的化学方程式2AgNO3=2Ag+2NO2↑+O2↑。现有硝酸钾、硝酸铜和硝酸银三种盐中的一种纯净物或多种组成的混合物,受热分解时生成m升气体,被水充分吸收后剩余m/ 试题难度:难 1 答案:B 解析:根据质量守恒,5摩尔硝酸铵分解生成2摩尔硝酸和9摩尔水,另外的是氮气。
2答案:硝酸银;硝酸铜与硝酸钾(物质的量之比为1:1);硝酸铜、硝酸钾、硝酸银(硝酸铜和硝酸钾物质的量之比为1:1,硝酸银为任意) 解析:根据剩余气体的1/6,说明发生了NO2、O2和水的反应,4NO2+O2 + 2H2O = 4HNO3 然后考虑二氧化氮和氧气的过量问题,即剩余1/6是氧气或是NO 的问题。若剩余为氧气,要求NO2、O2物质的量的关系为2:1,硝酸银任意都符合,硝酸钾和硝酸铜1:1组合也可以。然后若剩余是NO,即NO2 过量,要求NO2、O2物质的量的关系为9:1。(无论怎么组合也不可能)。
战场上的指路明灯 在电视或电影里,我们经常看到军队作战时,靠信号弹传递消息。信号弹发射后,会发出五颜六色的焰火,你知道这利用的是什么原理吗?其实这些信号弹里装的是普普通通的化学药品——金属盐类。原来,许多金属盐类在高温下能够射出各种彩色的光芒。例如,硝酸钠与碳酸钠会发出黄光,硝酸镁发出红光,硝酸钡发出绿光,碳酸铜、硫酸铜会发出蓝光,铝粉、铝镁合金会发出白光,等等这种现象,在化学上叫做焰色反应。我们平时放的烟花,里面装有燃烧剂、助燃剂、发光剂和发色剂。燃烧剂也是用黑色火药做的。正因为黑色火药燃烧时能够产生大量的热与光,人们用它来把发光剂与发色剂引燃,并使焰火爆破,使发光剂向四面八方散开去。助燃剂由硝酸钾、硝酸钡等组成。硝酸钾、硝酸钡等一受热就分解,放出大量的氧,使燃烧剂烧得更猛。发光剂是铝粉或者镁粉,这些金属的粉末能够猛烈燃烧,放出强烈的光芒。发色剂是利用金属盐来实现的。催泪弹中装有镁铝、硝酸钠和硝酸钡等物质。引爆后,镁在空气中迅速燃烧,放出含紫外线的耀眼白光,同时放出热量使硝酸盐分解,氧又进一步促进镁、铝燃烧。催泪弹中还装有易挥发的液溴,它能刺激人的敏感部位——眼鼻等器官黏膜,催人泪下。有时还装有毒剂——西埃斯,它会引起大量流泪、剧烈咳嗽、喷嚏不止,令人难以忍受,严重的可导致死亡。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |


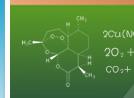
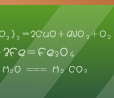










通过以上实验,判断以下物质的稳定性并说明理由:NaNO2和NaNO3