|
高中化学 > 非金属性比较
非金属性比较
操作方法 取三支试管,分别加入少量氯化钠,溴化钠,碘化钠晶体,并各加入少量蒸馏水,使其溶解。然后分别加入1毫升氯水,注意观察溶液颜色变化。另取三支试管,用溴水代替上述实验中的氯水,做相同实验。 实验现象 向三支试管中加入氯水后,盛氯化钠溶液的试管没什么变化,盛溴化钠,碘化钠溶液的试管溶液颜色加深。盛碘化钠溶液的试管呈浅黄色或橙色,盛溴化钠溶液的试管呈黄色或褐色。另取溴水做实验时,盛氯化钠,溴化钠的试管溶液颜色无明显变化,而盛碘化钠的试管里的溶液颜色加深,呈黄色或褐色。 从上述实验可知加入氯水,溴水后,溶液颜色发生变化,说明发生了化学反应,氯可置换溴化钠中的溴和碘化钠中的碘,使溶液颜色加深。从而也说明非金属性氯>溴>碘。从以上实验可得出同一主族元素随原子序数增加,电子层数递增,得电子能力逐渐减弱,失电子能力逐渐增强,金属性逐渐增强,非金属性逐渐减弱。 1、非金属性的含义和判断方法;2、同主族元素性质的递变性、相似性与差异性。
1、卤族元素从F→I性质递变规律正确的是( ) A、阴离子还原性逐渐减小 B、单质的氧化性逐渐增强 C、最低价氢化物水溶液酸性逐渐减弱 D、单质颜色逐渐加深 试题难度:易 2、将足量的氯气通入下列溶液中,原溶液中溶质产生的阴阳离子都改变的是( ) A、AgNO3 B、Na2CO 试题难度:中 3、将KCl和KBr的混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为( ) A、3∶2∶1 B、1∶2∶3 C、1∶3∶2 D、3∶1∶1 试题难度:难 1 答案:D 2 答案:D 解析:阴阳离子都改变,说明阴阳离子都发生了化学反应。 3 答案:A 解析:正常计算可以用差量法先求出KBr的质量,再求出KCl的质量,从而得解。作为选择题,也可以利用电荷守恒逐项分析,只有A项符合。 比较元素非金属性强弱 元素的非金属性是指元素的气态原子得电子的能力,综合中学化学内容,比较元素非金属性强弱,可以从以下几种不同的方面予以分析、判断。 1、利用原子结构和元素周期表 在元素周期表中,同一周期从左至右,元素的非金属性逐渐增强,同一主族从上至下,元素的非金属性逐渐减弱。 2、比较单质跟氢气反应的能力 一般说来,非金属性强的元素其单质越容易跟氢气反应,反应现象越剧烈,生成的气态氢化物越稳定。反之,则非金属性越弱。根据这一原则,卤族元素中非金属性由强到弱的顺序依次为F、Cl、Br、I。 3、根据物质间置换反应判断 一般说来,强氧化剂跟强还原剂反应生成较弱还原剂和较弱氧化剂。如: Cl2+2NaBr=2NaCl+Br2 非金属性Cl>Br Br2+H2S=2HBr+S↓ 非金属性Br>S 4、比较跟金属反应的难易和化合价高低 一般说来,越易跟金属反应且使金属呈高价化合物的元素,非金属性越强。如: 2Fe+3Cl2 5、比较最高氧化物对应水化物酸性强弱 一般说来,酸性越强,则该非金属元素的非金属性越强。如: ∵ 酸性 HClO4>H2SO4>H3PO4>H2CO3>H2SiO3 ∴ 非金属性 Cl>S>P>C>Si  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |


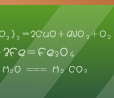










已知置换反应:2KClO3+I2=2KIO3+Cl2,根据该反应能得到非金属性顺序I>Cl吗?为什么?