|
高中化学 > 原电池原理的实验
原电池原理的实验
操作方法 把一块纯净的锌片插入盛有稀硫酸的烧杯里,观察发生的现象,再插入一块铜片,观察铜片上有没有气体放出。用导线把锌片和铜片连接起来,观察铜片上有没有气体放出。在导线中部接入一个电流计,观察指针是否偏转。 实验现象 锌片插入稀硫酸中时,锌片表面有气泡逸出。再插入铜片时,锌片表面继续有气体放出,铜片上没有气体放出,当把锌片和铜片连接起来后,铜片上有气体放出,在导线中间连入电流计后,电流计指针发生偏转。 Zn与稀H2SO4可发生置换反应,方程式为 Zn + H2SO4 === ZnSO4 + H2↑。当将Cu片与锌连接起来后,插入稀H2SO4中构成原电池。负极Zn: Zn-2e-==Zn2+ ,正极Cu: 2H++2e-=H2↑ ,所以看到铜片上有气体放出,由于失去的电子沿导线流动到铜片,在铜片一端得电子生成氢气,电路中有电子定向流动,所以电流计指针发生偏转。 1、原电池形成的条件;2、电极名称以及电极反应、总反应方程式书写与判断。3、电子或电流的方向
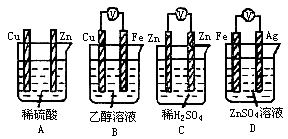
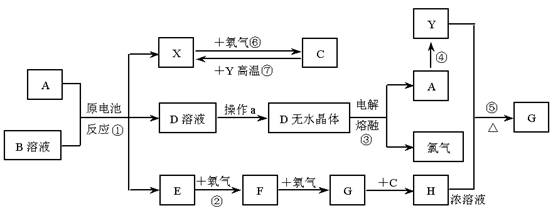
1、下列装置能够构成原电池产生电流的是 试题难度:易 2、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: 在此电池放电时,负极上发生反应的物质是 A、Ag2O B、Ag C、Zn(OH)2 D、Zn 试题难度:中 3、已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图: (注意:其中有些反应的条件及部分生成物被略去) 请填写下列空白: (1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。 (2)从D溶液制备D的无水晶体的“操作a”为 。 (3)反应②的化学方程式为 。 (4)反应⑤的化学方程式为 。 (5)原电池反应①中正极的电极反应式为 。 试题难度:难 1 答案:D 解析:形成原电池必须同时满足三个条件:活泼性不同的两个电极、电解质溶液、形成闭合回路。 2 答案:D 解析:放电时,发生的是原电池反应,负极表现为失电子发生氧化反应,发生反应的物质是Zn。 3 答案:(1)2Mg+CO2===2MgO+C;(2)将D溶液在HCl气流中蒸干; (5)2NH4++2e- = 2NH3↑+H2↑
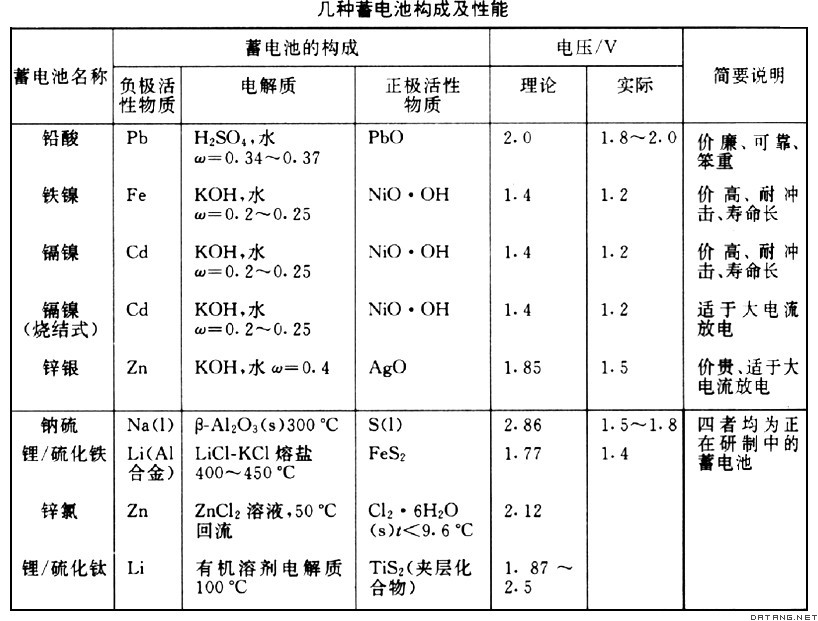
蓄电池 放电后可充电再用的化学电源。又称二次电池。放电时它是自发电池,充电时它是电解电池。蓄电池中活性物质耗尽后,用外接直流电源充电使活性物质再生,可以反复多次循环使用,高达百次甚至几千次。常用电池容量(电池输出电量)、电池能量密度(电池输出电能与电池质量或体积比值)等参数描述其性能。蓄电池类型较多(见表),其中铅酸、碱性铁镍蓄电池应用较广。随着科学的发展及特殊性能的要求,促进各种新型蓄电池的研究。
标准电池 国际上规定的作为电动势测量标准的电池。其电动势必须精确已知,且能长期保持稳定不变。常用的是韦斯顿电池,电池表达式为: 电池负极为镉汞齐,正极为Hg与Hg2SO4的糊状物,电解液为酸性的饱和 CdSO4 水溶液,实际上是饱和的硫酸镉和硫酸亚汞水溶液。电池反应为:  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |


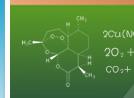
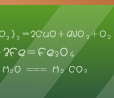










利用某些果蔬中的汁液作电解质溶液,用芯片和碳棒、导线、耳机等易得材料制作水果电池。