|
高中化学 > 研究金属电化腐蚀原因的实验
研究金属电化腐蚀原因的实验
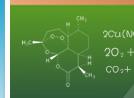
操作方法 在一个试管里放一小块纯锌,在另一试管里放一小块含有杂质的锌,然后在两个试管里各注入同浓度的稀硫酸。观察现象。然后在盛纯锌和稀硫酸的试管里,加入少量的硫酸铜溶液,观察现象。 实验现象 含有杂质的锌与硫酸溶液反应后放出氢气速率比纯锌与稀硫酸反应放出氢气的速率快。向盛纯锌和稀硫酸的试管里加入少量硫酸铜后,放出气体的速率加快。
金属中含有导电且更不活泼的杂质时,会加快金属的腐蚀。原因是活泼性不同的两种物质与电解质溶液形成了很多个微小的原电池,加快了反应速率。
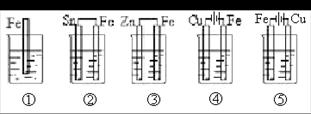
1、电化腐蚀的本质原因与危害。2、减少甚至防止电化腐蚀的方法
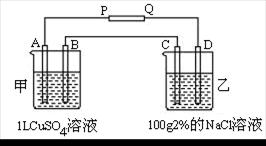
1、钢铁发生电化学腐蚀时,负极发生的反应是 ( ) A、2H++2e-=H2 B、2H2O+O2+4e-=4OH- C、Fe-2e-=Fe2+ D、4OH--4e-=2H2O+O2 试题难度:易 2、如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是 ( ) A、④>②>①>③>⑤ B、②>①>③>⑤>④ C、④>②>③>①>⑤ D、⑤>③>②>④>① 试题难度:中 3、如图所示,已知A、B、C、D为铂电极,P、Q为直流电源的两极,通电发现B极增重, ①P、Q哪个是正极? ②当甲池溶液的pH由6.0降至2.0时,B极增重多少克? ③此时乙池溶液的浓度由2%变为多少? 试题难度:难 1 答案:C 解析:钢铁发生电化学腐蚀时,负极上发生的电极反应是:Fe-2e-=Fe2+;正极上发生吸氧腐蚀是:2H2O+O2+4e-=4OH-。 2 答案:A 解析:金属腐蚀的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐蚀措施的腐蚀。 3 答案:①P为正极 ②0.32g ③1.42% 解析:通电发现B极增重,说明B电极上有金属铜析出,B为阴极,则P为正极。当甲池溶液的pH由6.0降至2.0时,说明产生的H+的物质的量为0.01摩,转移电子数也为0.01摩,生成金属铜0.005摩,即0.005×64=0.32g。同时乙池中也转移0.01摩电子,消耗Cl-0.01摩,剩余(100×2%/58.5-0.01)×58.5/(100-0.01×36.5)=1.415/99.635=1.42% 不锈钢简介 耐空气、蒸汽、水等弱腐蚀介质和酸、碱、盐等化学浸蚀性介质腐蚀的钢。又称不锈耐酸钢。实际应用中,常将耐弱腐蚀介质腐蚀的钢称为不锈钢,而将耐化学介质腐蚀的钢称为耐酸钢。由于两者在化学成分上的差异,前者不一定耐化学介质腐蚀,而后者则一般均具有不锈性。不锈钢的耐蚀性取决于钢中所含的合金元素。铬是使不锈钢获得耐蚀性的基本元素,当钢中含铬量达到12%左右时,铬与腐蚀介质中的氧作用,在钢表面形成一层很薄的氧化膜(自钝化膜),可阻止钢的基体进一步被腐蚀。除铬外,常用的合金元素还有镍、钼、钛、铌、铜、氮等,以满足各种用途对不锈钢组织和性能的要求。不锈钢通常按基体组织分为:①铁素体不锈钢。含铬12%~30%。其耐蚀性、韧性和可焊性随含铬量的增加而提高 , 耐氯化物应力腐蚀性能优于其他种类不锈钢。②奥氏体不锈钢。含铬大于18%,还含有 8%左右的镍及少量钼、钛、氮等元素。综合性能好,可耐多种介质腐蚀。③奥氏体 - 铁素体双相不锈钢。兼有奥氏体和铁素体不锈钢的优点,并具有超塑性。④马氏体不锈钢。强度高,但塑性和可焊性较差。 今年出现了一种“新物质”—不锈铁,其性质与不锈钢相似:不生锈。请探讨不锈铁不易生锈的原因。 电化学腐蚀 金属材料与电解质溶液接触 , 通过电极反应产生的腐蚀。电化学腐蚀反应是一种氧化还原反应。在反应中,金属失去电子而被氧化,其反应过程称为阳极反应过程,反应产物是进入介质中的金属离子或覆盖在金属表面上的金属氧化物(或金属难溶盐);介质中的物质从金属表面获得电子而被还原,其反应过程称为阴极反应过程。在阴极反应过程中,获得电子而被还原的物质习惯上称为去极化剂。 在均匀腐蚀时,金属表面上各处进行阳极反应和阴极反应的概率没有显著差别,进行两种反应的表面位置不断地随机变动。如果金属表面有某些区域主要进行阳极反应,其余表面区域主要进行阴极反应,则称前者为阳极区,后者为阴极区,阳极区和阴极区组成了腐蚀电池。直接造成金属材料破坏的是阳极反应,故常采用外接电源或用导线将被保护金属与另一块电极电位较低的金属相联接,以使腐蚀发生在电位较低的金属上。 防腐蚀技术 对在腐蚀性介质中的金属材料及其制品采用的各种不同的防腐蚀技术。它可以延长金属制品的使用寿命,保证工艺设备的安全和顺利运行。防腐蚀技术主要有下列几类:①合理选材。这是防止和控制设备腐蚀的最普通和最有效的方法之一。选材必须了解环境因素和腐蚀因素,包括介质的种类、浓度、温度、压力、流动状态、杂质种类和数量、含氧量,以及有无固体悬浮物和微生物等;研究有关资料数据;按实际条件进行模拟试验,以获得选材的可靠数据,以此了解材料的耐蚀性能及其工艺特性;综合考虑材料的耐蚀性和经济性;考虑合适的防腐蚀措施。②表面防护。金属材料及其制品表面经处理后形成的防护层,可以使金属表面与外界介质隔开,阻止两者发生作用,同时还能取得装饰性外观。表面防护是防止或减轻基体金属腐蚀应用最普遍的方法。表面防护层常见的有金属镀层和非金属涂层两类。金属表面镀层方法有扩散渗镀、喷镀、电镀。非金属涂层常用于提高制品的耐蚀性和装饰性,有机涂层有涂料(包括油漆)、塑料、橡胶等。无机涂层有搪瓷、玻璃等。③环境(介质)处理。即改变起腐蚀作用的介质的性质,以防止或减轻介质对金属制品或设备的腐蚀。这种方法只能在有腐蚀性的介质的体积有限的条件下使用。环境处理分为:除去或减少介质中的有害组分(常用的方法有去湿、防尘、除氧、脱盐)和添加缓蚀剂(在腐蚀介质中加入能显著降低腐蚀速度的物质)两类。④电化学保护。即根据电化学原理来控制金属在电解质溶液中的腐蚀,包括阴极保护和阳极保护。 探讨课题
分析一下家里铁锅容易生锈的原因,以及防锈措施。
最新评论共有 位网友发表了评论
查看所有评论
发表评论
 北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |