|
高中化学 > 浓度对化学反应速率的影响
浓度对化学反应速率的影响
操作方法 取三支洁净的试管,分别编为1、2、3号,分别加入不同浓度硫代硫酸钠溶液。把试管放在一张有字的纸前,这时隔着试管可以清楚地看到字迹,然后再加硫酸。从加入第一滴硫酸开始,到溶液出现浑浊使试管后面的字迹看不见时,观察模糊的速度。注意:本实验是在不同浓度下比较其反应速率,所以三支试管应同时加入稀硫酸,要一次性加入。 实验现象 三支试管都变浑浊,但它们变浑浊的时间不同,按1、2、3号顺序变浑浊的速度越来越快。 按1、2、3号反应物的浓度越来越大,反应速率越来越快。即增大反应物的浓度,反应速率加快。 浓度对化学反应速率影响的本质。
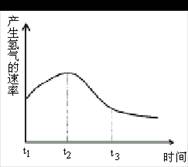
1、把 0.6molX气体和0.4molY气体混合于 A、1 B、 试题难度:易 2、下列条件一定能使反应速率加快的是:①增加反应物的物质的量②升高温度③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2 ( ) A、全部 B、①②⑤ C、② D、②③ 试题难度:中 3、把除去氧化膜的镁条投入到盛有盐酸的试管中,测得产生氢气的速率变化如下图所示。试说明在t1~t2时间内反应速率变化的原因是 ,t2~t3时间内,反应速率变化的原因是 。 试题难度:难 1 答案:A 解析:利用化学反应速率之比等于反应方程式中化学计量数之比进行计算。 2 答案:C 解析:对于固体和纯液体,增加反应物的物质的量不增加该物质的浓度,不影响反应速率。 3 答案:因为镁和盐酸反应是放热反应,所以随着温度升高,反应速率加快,而随着反应的进行,盐酸浓度降低,因而反应速率减慢。 化学反应速率 物质能否发生化学反应以及它们反应能力的大小,是一个古老的化学理论课题。早期的化学家们一直以含糊不清的“化学亲和力”、“化学力”、“作用力”等概念来表述和解释这些问题。直到19世纪初,人们仍不能将物质发生化学反应的可能性和实际发生时的化学反应速率正确区分开。 第2章中讨论的化学热力学所解决的问题是化学反应的自发性或方向以及化学反应进行的程度,即讨论化学反应能否发生和可能达到的限度,也就是说是讨论过程的趋向性和限度问题。但是可能性不等于现实性,如果两个水池里的水存在水位差,则热力学告诉我们高位水池里的水有流向低位水池的趋势(方向性),若使它们相通,那么它们最终将取得一致的水位(平衡状态,限度)。然而热力学却不能说明什么时候能达到这种平衡状态,如果管道很细,则这个过程可能要经历较长时间,这就涉及速率的问题。化学反应也一样,有些化学反应进行得很快,如酸碱中和反应,另一些反应则进行得较为缓慢。如从热力学方面看,氢和氧化合生成水的反应具有显著的自发倾向(Ko很大),但实际上氢和氧的混合气体在室温下可以长期存在而不发生显著的变化,许多有机化合物之间的反应也进行得较为缓慢。对一些化学反应,特别是对工农业生产有利的化学反应,需采取措施来增大反应速率以提高劳动生产率,如钢铁冶炼,氨、树脂、橡胶的合成等;但对另一些反应,则要设法抑制其进行,如金属的腐蚀、橡胶制品的老化等。要研究化学反应的速率问题,则要依赖化学动力学(chemicalkinetics)。 1850年法国的威尔汉密(L.Wilhemy,1812~1864)用旋光计研究了蔗糖在不同浓度、温度和酸催化下的转化,得出转化速率的数学表达式,并指出其他同类型反应的方程形式也相同,开始了化学动力学早期的定量研究。 从1877年之后,范特霍夫开始注意研究化学动力学和化学亲和力问题。1884年,他出版了《化学动力学研究》一书。书中他不仅阐明了反应速率等化学动力学问题,而且还专门论述了化学平衡理论和以自由能为基础的亲和力理论。这本书首先着重讨论了化学反应速率及其变化规律。他创造性地把反应速率分为单分子、双分子和多分子反应三种不同类别来研究。此后,众多的科学家在化学动力学领域辛勤耕耘,并取得累累硕果。 近代化学动力学是研究化学反应过程的速率和反应机理的物理化学分支学科。它的研究对象是物质性质随时间变化的非平衡的动态体系。时间是化学动力学的一个重要变量。 化学动力学的研究方法主要有两种:一种是唯象动力学研究方法,也称经典化学动力学研究方法,它是从化学动力学的原始实验数据——浓度与时间的关系出发,经过分析获得某些反应动力学参数——反应速率常数、活化能、指前因子等,这些参数可以用来表征反应体系的速率,是探讨反应机理的有效数据;另一种是分子反应动力学研究方法,原则上,如果能从量子化学理论计算出反应体系的正确的势能面,并应用力学定律计算具有代表性的点在其上的运动轨迹,就能计算反应速率和化学动力学的参数。但是,除了少数很简单的化学反应以外,量子化学的计算至今还不能得到反应体系的可靠的、完整的势能面。因此,现行的反应速率理论仍不得不借用经典统计力学的处理方法。  北京高拓电子科技有限责任公司 北京壹灵壹教育科技股份有限公司 Copyright 2015-2016 chinaedu.com,All Rights Reserved 京ICP备11011674号-1 全国客服电话:400-6869-101 传真:010-84640631  |












大家都知道:中学阶段,我们不用纯固体来表达化学反应速率。请讨论:如果用纯固体来表达的话,应该如何表达?